高二化学选修四知识点总结推荐
相关文章
成功源于发现细节,没有细节就没有机遇,留心细节意味着创造机遇。一件司空见惯的小事或许就可能是打开机遇宝库的钥匙!下面给大家分享一些关于高二化学知识点复习,希望对大家有所帮助。
高二化学选修四知识点总结推荐 1
高二化学选修四知识点总结推荐 2
1.电解饱和食盐水
(1)电极反应
阳极反应式:2Cl--2e-=Cl2↑(氧化反应)
阴极反应式:2H++2e-=H2↑(还原反应)
(2)总反应方程式
2NaCl+2H2O2NaOH+H2↑+Cl2↑
离子反应方程式:2Cl-+2H2O
2OH-+H2↑+Cl2↑
(3)应用:氯碱工业制烧碱、氯气和氢气。
2.电镀
以金属表面镀银为例,
(1)镀件作阴极,镀层金属银作阳极。
(2)电解质溶液是AgNO3溶液等含镀层金属阳离子的盐溶液。
(3)电极反应:
阳极:Ag-e-=Ag+;
阴极:Ag++e-=Ag。
(4)特点:阳极溶解,阴极沉积,电镀液的浓度不变。
3.电解精炼铜
(1)电极材料:阳极为粗铜;阴极为纯铜。
(2)电解质溶液:含Cu2+的盐溶液。
(3)电极反应:
阳极:
Zn-2e-=Zn2+
Fe-2e-=Fe2+
i-2e-=Ni2+
Cu-2e-=Cu2+;
阴极:
Cu2++2e-=Cu。
4.电冶金
利用电解熔融盐的方法来冶炼活泼金属Na、Ca、Mg、Al等。
(1)冶炼钠
2NaCl(熔融)电解2Na+Cl2↑
电极反应:
阳极:
2Cl--2e-=Cl2↑;
阴极:
2Na++2e-=2Na。
(2)冶炼铝
2Al2O3(熔融)4Al+3O2↑
电极反应:
阳极:6O2--12e-=3O2↑;
阴极:4Al3++12e-=4Al。
高二化学选修四知识点总结推荐 3
化学反应条件的优化——工业合成氨
1、合成氨反应的限度
合成氨反应是一个放热反应,同时也是气体物质的量减小的熵减反应,故降低温度、增大压强将有利于化学平衡向生成氨的方向移动。
2、合成氨反应的速率
(1)高压既有利于平衡向生成氨的方向移动,又使反应速率加快,但高压对设备的要求也高,故压强不能特别大。
(2)反应过程中将氨从混合气中分离出去,能保持较高的反应速率。
(3)温度越高,反应速率进行得越快,但温度过高,平衡向氨分解的方向移动,不利于氨的合成。
(4)加入催化剂能大幅度加快反应速率。
3、合成氨的适宜条件
在合成氨生产中,达到高转化率与高反应速率所需要的条件有时是矛盾的,故应该寻找以较高反应速率并获得适当平衡转化率的反应条件:一般用铁做催化剂 ,控制反应温度在700K左右,压强范围大致在1×107Pa~1×108Pa 之间,并采用N2与H2分压为1∶2.8的投料比。
高二化学选修四知识点总结推荐 4
化学热化学方程式是什么
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。
化学热化学反应方程式的书写
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
高二化学选修四知识点总结推荐 5
考点1:吸热反应与放热反应
1、吸热反应与放热反应的区别
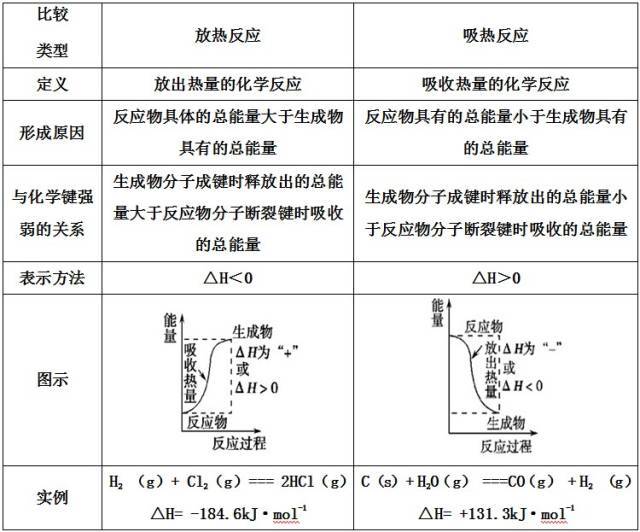
特别注意:反应是吸热还是放热与反应的条件没有必然的联系,而决定于反应物和生成物具有的总能量(或焓)的相对大小。
2、常见的放热反应
①一切燃烧反应;
②活泼金属与酸或水的反应;
③酸碱中和反应;
④铝热反应;
⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。
3、常见的吸热反应
①Ba(OH)2·8H2O与NH4Cl反应;
②大多数分解反应是吸热反应
③等也是吸热反应;
④水解反应
考点2:反应热计算的依据
1.根据热化学方程式计算
反应热与反应物各物质的物质的量成正比。
2.根据反应物和生成物的总能量计算
ΔH=E生成物-E反应物。
3.根据键能计算
ΔH=反应物的键能总和-生成物的键能总和。
4.根据盖斯定律计算
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
温馨提示:
①盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。
②热化学方程式之间的“+”“-”等数学运算,对应ΔH也进行“+”“-”等数学计算。
5.根据物质燃烧放热数值计算:Q(放)=n(可燃物)×|ΔH|。


