高二化学重点知识点精选推荐
相关文章
化学是一门严密的自然科学,前后联系十分广泛,高二的化学内容有着承上启下的作用,学好这个阶段化学知识经有利于以后的高考。下面是小编为大家整理的高二化学必备的知识点,希望对大家有用!
高二化学重点知识点精选推荐 1
1——原子半径
(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;
(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2——元素化合价
(1)除第1周期外,同周期从左到右,元素正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);
(2)同一主族的元素的正价、负价均相同
(3)所有单质都显零价
3——单质的熔点
(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;
(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增
4——元素的金属性与非金属性(及其判断)
(1)同一周期的元素电子层数相同。因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增;
(2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。
判断金属性强弱
金属性(还原性)1,单质从水或酸中置换出氢气越容易越强
2,价氧化物的水化物的碱性越强(1—20号,K;总体Cs最
非金属性(氧化性)1,单质越容易与氢气反应形成气态氢化物
2,氢化物越稳定
3,价氧化物的水化物的酸性越强(1—20号,F;最体一样)
5——单质的氧化性、还原性
一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;
元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
推断元素位置的规律
判断元素在周期表中位置应牢记的规律:
(1)元素周期数等于核外电子层数;
(2)主族元素的序数等于最外层电子数。
阴阳离子的半径大小辨别规律
由于阴离子是电子最外层得到了电子而阳离子是失去了电子
6——周期与主族
周期:短周期(1—3);长周期(4—6,6周期中存在镧系);不完全周期(7)。
主族:ⅠA—ⅦA为主族元素;ⅠB—ⅦB为副族元素(中间包括Ⅷ);0族(即惰性气体)
所以,总的说来
(1)阳离子半径<原子半径
(2)阴离子半径>原子半径
(3)阴离子半径>阳离子半径
(4对于具有相同核外电子排布的离子,原子序数越大,其离子半径越小。
以上不适合用于稀有气体!
高二化学重点知识点精选推荐 2
盐类的水解(只有可溶于水的盐才水解)
1、盐类水解:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
2、水解的实质:水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离,是平衡向右移动,促进水的电离。
3、盐类水解规律:
①有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱都水解,同强显中性。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。(如:Na2CO3>NaHCO3)
4、盐类水解的特点:
(1)可逆(与中和反应互逆)
(2)程度小
(3)吸热
5、影响盐类水解的外界因素:
①温度:温度越高水解程度越大(水解吸热,越热越水解)
②浓度:浓度越小,水解程度越大(越稀越水解)
③酸碱:促进或抑制盐的水解(H+促进阴离子水解而抑制阳离子水解;OH-促进阳离子水解而抑制阴离子水解)
6、酸式盐溶液的酸碱性:
①只电离不水解:如HSO4-显酸性
②电离程度>水解程度,显酸性(如:HSO3-、H2PO4-)
③水解程度>电离程度,显碱性(如:HCO3-、HS-、HPO42-)
7、双水解反应:
(1)构成盐的阴阳离子均能发生水解的反应。双水解反应相互促进,水解程度较大,有的甚至水解完全。使得平衡向右移。
(2)常见的双水解反应完全的为:Fe3+、Al3+与AlO2-、CO32-(HCO3-)、S2-(HS-)、SO32-(HSO3-);S2-与NH4+;CO32-(HCO3-)与NH4+其特点是相互水解成沉淀或气体。双水解完全的离子方程式配平依据是两边电荷平衡,如:2Al3++3S2-+6H2O==2Al(OH)3↓+3H2S↑
高二化学重点知识点精选推荐 3
电解质:在水溶液中或熔融状态下能导电的化合物
非电解质:在水溶液中和熔融状态下都不能导电的化合物
离子方程式的书写:
第一步:写:写出化学方程式
第二步:拆:易溶于水、易电离的物质拆成离子形式;
难溶(如CaCO3、BaCO3、BaSO4、AgCl、AgBr、AgI、Mg(OH)2、Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2等),难电离(H2CO3、H2S、CH3COOH、HClO、H2SO3、NH3·H2O、H2O等),气体(CO2、SO2、NH3、Cl2、O2、H2等),氧化物(Na2O、MgO、Al2O3等)不拆
第三步:删:删去前后都有的离子
第四步:查:检查前后原子个数,电荷是否守恒
离子共存问题判断:①是否产生沉淀(如:Ba2+和SO42-,Fe2+和OH-);
②是否生成弱电解质(如:NH4+和OH-,H+和CH3COO-)
③是否生成气体(如:H+和CO32-,H+和SO32-)
④是否发生氧化还原反应(如:H+、NO3-和Fe2+/I-,Fe3+和I-)
高二化学重点知识点精选推荐 4
考点1:化学反应速率
1、化学反应速率的表示方法___________。
化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。表达式:___________ 。
其常用的单位是__________ 、 或__________ 。
2、影响化学反应速率的因素
1)内因(主要因素)
反应物本身的性质。
2)外因(其他条件不变,只改变一个条件)

3、理论解释——有效碰撞理论
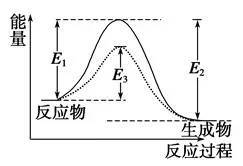
(1)活化分子、活化能、有效碰撞
①活化分子:能够发生有效碰撞的分子。
②活化能:如图
图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。(注:E2为逆反应的活化能)
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
考点2:化学平衡
1、化学平衡状态:一定条件(恒温、恒容或恒压)下的可逆反应里,正反应和逆反应的速率相等,反应混合物(包括反应物和生成物)中各组分的浓度保持不变的状态。
2、化学平衡状态的特征
3、判断化学平衡状态的依据
考点3:化学平衡的移动
1、概念
可逆反应中旧化学平衡的破坏、新化学平衡的建立,由原平衡状态向新化学平衡状态的转化过程,称为化学平衡的移动。
2、化学平衡移动与化学反应速率的关系
(1)v正>v逆:平衡向正反应方向移动。
(2)v正=v逆:反应达到平衡状态,不发生平衡移动。
(3)v正
3、影响化学平衡的因素
4、“惰性气体”对化学平衡的影响
①恒温、恒容条件
原平衡体系体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
②恒温、恒压条件
原平衡体系容器容积增大,各反应气体的分压减小―→体系中各组分的浓度同倍数减小
5、勒夏特列原理
定义:如果改变影响平衡的一个条件(如C、P或T等),平衡就向能够减弱这种改变的方向移动。
原理适用的范围:已达平衡的体系、所有的平衡状态(如溶解平衡、化学平衡、电离平衡、水解平衡等)和只限于改变影响平衡的一个条件。
勒夏特列原理中“减弱这种改变”的解释:外界条件改变使平衡发生移动的结果,是减弱对这种条件的改变,而不是抵消这种改变,也就是说:外界因素对平衡体系的影响占主要方面。
高二化学重点知识点精选推荐 5
混和物 强电解质:。如HCl、NaOH、NaCl、BaSO4 弱电解质:。如H2O、HClO、NH3· H2O、Cu(OH)2、、H、HO…… 。如SO3、CO2、C6H12O6、CCl4、CH2=CH2……
1.电解质和非电解质:在水溶液中或熔融状态时是否能够导电的化合物。
2.强电解质与弱电解质:在水溶液中能否完全电离的电解质;与溶解度和导电能力无关。
强电解质与弱电质的本质区别:在水溶液中是否(或是否存在电离平衡)
注意:①电解质、非电解质都是化合物
②SO2、NH3、CO2等属于非电解质
③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4
为强电解质)---电解质的强弱与导电性、溶解性无关。
3.电离平衡——在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结
合成分子的速率相等时,电离过程就达到了平衡状态。
4.强弱电解质可通过实验证明进行判定的方法有(以CH3COOH简写为HAc为例):
(1)溶液导电性对比实验;
(2)测0.01mol/LHAc溶液的pH2;
(3)测NaAc溶液的pH值;pH7,则说明HAc为弱电解质
(4)测pH= a的HAc稀释100倍后所得溶液pH a +2
(5)将物质的量浓度相同的HAc溶液和NaOH溶液等体积混合后溶液呈 性
(6)中和10mLpH=1的HAc溶液消耗pH=13的NaOH溶液的体积 10mL;
(7)将pH=1的HAc溶液与pH=13的NaOH溶液等体积混合后溶液呈性
(8)比较物质的量浓度相同的HAc溶液与盐酸分别与同样的锌粒反应产生气体的速率,此法中的
锌粒的表面积不好确定一模一样。
5.强酸(HA)与弱酸(HB)的区别:
(1) 溶液的物质的量浓度相同时,pH(HA)pH(HB)
(2) pH值相同时,溶液的浓度CHACHB
(3) pH相同时,加水稀释同等倍数后,pHHA pHHB
6.影响因素:
温度——电离过程是吸热过程,温度升高,平衡向电离方向移动。
浓度——弱电解质浓度越大,电离程度越小。
同离子效应——在弱电解质溶液中加入同弱电解质具有相同离子的强电解质,使电离平衡向
逆方向移动。
化学反应——在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质时,可以
使电离平衡向电离方向移动。
7.电离方程式的书写---多元弱酸的电离应分步完成电离方程式,多元弱碱则一步完成电离方程式。
8.水的电离:水是一种极弱的电解质,能微弱电离。
+—9.水的离子积常数——Kw= C(H)×C(OH)
-14Kw取决于温度,不仅适用于纯水,还适用于其他稀溶液。25℃时,Kw =1×10
--+在水溶液中,Kw中的C(OH)、C(H)指溶液中总的离子浓度.
-14常温下,任何稀的水溶液中均存在离子积常数,且Kw =1×10 。
+-不论是在中性溶液还是在酸碱性溶液,水电离出的C(H)=C(OH)
+-+-根据Kw=C(H)×C(OH) 在特定温度下为定值,C(H) 和C(OH) 可以互求。
10.影响水的电离平衡移动的因素:
①升温:促进水的电离;
②酸或碱抑制水的电离;
③盐类的水解促进水的电离;
+ -12例如:pH=2的硫酸溶液中,由水电离的C(H)=10mol/L
+ -2pH=2的硫酸铵溶液中,由水电离的C(H)=10mol/L,
+ -2 -12所以pH=2的溶液中,由水电离的C(H)可能为10mol/L也可能为10mol/L。反过来,由水电
+ -12离的C(H)=10mol/L的溶液,pH可能为2也可能为12.
11.电离常数:
K值越大,电离程度越大,相应酸 (或碱)的酸(或碱)性越强。
电离度:,弱电解质浓度越大,电离程度越小。


