高一化学知识点:常见物质的分离、提纯和鉴别集锦合集
相关文章
化学是我们生活中不可缺少的,他能让你产生一个新的世界,寻找更美好的东西,尤其是金属物质。以下是小编为你推荐的高一化学金属知识点,随我一起了解吧!
高一化学知识点:常见物质的分离、提纯和鉴别集锦合集 1
对物质的分离可一般先用化学方法对物质进行处理,然后再根据混合物的特点用恰当的分离方法(见化学基本操作)进行分离.
用化学方法分离和提纯物质时要注意:
①最好不引入新的杂质;
②不能损耗或减少被提纯物质的质量
③实验操作要简便,不能繁杂.用化学方法除去溶液中的杂质时,要使被分离的物质或离子尽可能除净,需要加入过量的分离试剂,在多步分离过程中,后加的试剂应能够把前面所加入的无关物质或离子除去.
对于无机物溶液常用下列方法进行分离和提纯:
(1)生成沉淀法 (2)生成气体法 (3)氧化还原法 (4)正盐和与酸式盐相互转化法 (5)利用物质的两性除去杂质 (6)离子交换法
常见物质除杂方法
序号 原物 所含杂质 除杂质试剂 主要操作方法
1 N2 O2 灼热的铜丝网 用固体转化气体
2 CO2 H2S CuSO4溶液 洗气
3 CO CO2 NaOH溶液 洗气
4 CO2 CO 灼热CuO 用固体转化气体
5 CO2 HCI 饱和的NaHCO3 洗气
6 H2S HCI 饱和的NaHS 洗气
7 SO2 HCI 饱和的NaHSO3 洗气
8 CI2 HCI 饱和的食盐水 洗气
9 CO2 SO2 饱和的NaHCO3 洗气
10 炭粉 MnO2 浓盐酸(需加热) 过滤
11 MnO2 C -------- 加热灼烧
12 炭粉 CuO 稀酸(如稀盐酸) 过滤
13 AI2O3 Fe2O3 NaOH(过量),CO2 过滤
14 Fe2O3 AI2O3 NaOH溶液 过滤
15 AI2O3 SiO2 盐酸`氨水 过滤
16 SiO2 ZnO HCI溶液 过滤,
17 BaSO4 BaCO3 HCI或稀H2SO4 过滤
18 NaHCO3溶液 Na2CO3 CO2 加酸转化法
19 NaCI溶液 NaHCO3 HCI 加酸转化法
20 FeCI3溶液 FeCI2 CI2 加氧化剂转化法
21 FeCI3溶液 CuCI2 Fe 、CI2 过滤
22 FeCI2溶液 FeCI3 Fe 加还原剂转化法
23 CuO Fe (磁铁) 吸附
24 Fe(OH)3胶体 FeCI3 蒸馏水 渗析
25 CuS FeS 稀盐酸 过滤
26 I2晶体 NaCI -------- 加热升华
27 NaCI晶体 NH4CL -------- 加热分解
28 KNO3晶体 NaCI 蒸馏水 重结晶.
高一化学知识点:常见物质的分离、提纯和鉴别集锦合集 2
天然存在的二氧化硅称为硅石,包括结晶形和无定形.石英是常见的结晶形二氧化硅,其中无色透明的就是水晶,具有彩色环带状或层状的是玛瑙.二氧化硅晶体为立体网状结构,基本单元是[SiO4],因此有良好的物理和化学性质被广泛应用.(玛瑙饰物,石英坩埚,光导纤维)
物理:熔点高、硬度大、不溶于水、洁净的SiO2无色透光性好
化学:化学稳定性好、除HF外一般不与其他酸反应,可以与强碱(NaOH)反应,是酸性氧化物,在一定的条件下能与碱性氧化物反应
iO2+4HF==SiF4↑+2H2O
iO2+CaO===(高温)CaSiO3
iO2+2NaOH==Na2SiO3+H2O
不能用玻璃瓶装HF,装碱性溶液的试剂瓶应用木塞或胶塞.
高一化学知识点:常见物质的分离、提纯和鉴别集锦合集 3
氯水的成分:分子有:Cl2、H2O、HClO;离子有:H+、Cl-、ClO-、OH-
1.表现Cl2的性质:将氯水滴加到KI淀粉试纸上,试纸变蓝色。(氯水与碘化钾溶液的反应:Cl2+2KI==I2+2KCl。)
2.表现HClO的性质:用氯水漂白有色物质或消毒杀菌时,就是利用氯水中HClO的强氧化性,氧化色素或杀死水中病菌。
3.表现H+的性质:向碳酸钠溶液中滴加氯水,有大量气体产生,这是因为:
a2CO3+2HCl==2NaCl+H2O+CO2↑。
4.表现Cl-性质:向AgNO3溶液中滴加氯水,产生白色沉淀,再滴人稀HNO3,沉淀不溶解。
AgNO3+HCl=AgCl↓+HNO3。
5.体现H+和HClO的性质:在新制氯水中滴入紫色石蕊试液时,先变成红色,但红色迅速褪去。变红是因为氧水中H+表现的酸性,而褪色则是因为氯水中HClO具有的强氧化性。
漂白液:Cl2+2NaOH==NaCl+NaClO+H2O
漂白粉的制取原理:2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
漂白粉的有效成份是:Ca(ClO)2,起漂白作用和消毒作用的物质:HClO
漂粉精的有效成分:Ca(ClO)2
漂白原理:Ca(ClO)2+2HCl==CaCl2+2HClO
Ca(ClO)2+H2O+CO2==CaCO3↓+2HClO
次氯酸(HClO)的性质:.强氧化性:消毒、杀菌、漂白作用
不稳定性:见光易分解2HClO=2HCl+O2↑
弱酸性:酸性H2CO3﹥HClO证明事实Ca(ClO)2+H2O+CO2==CaCO3↓+2HClO
13.二氧化硫的性质:无色有刺激性气味的有毒气体,密度比空气大,酸性氧化物
与水反应SO2+H2O==H2SO3可逆反应H2SO3的不稳定性2H2SO3+O2==2H2SO4
还原性2SO2+O22SO3
通入酸性高锰酸钾中,使紫色溶液褪色
漂白性:SO2能使品红溶液褪色原理:与有色物质化合反应生成无色物质,该物质不稳定,加热恢复到原来颜色。
与氯水区别:氯水为永久性漂白原理:HClO具有强氧化性
氧化性:与还原性物质反应。如H2S
酸雨:PH〈5.6硫酸性酸雨的形成原因:SO2
来源:(主要)化石燃料及其产品的燃烧。(次要)含硫金属矿物的冶炼、硫酸生产产生的废气
防治:开发新能源,对含硫燃料进行脱硫处理,提高环境保护的意识
常见的环境保护问题:酸雨:SO2温室效应:CO2光化学烟雾:氮的氧化物
臭氧层空洞:氯氟烃(或氟里昂)白色垃圾:塑料垃圾等不可降解性物质
假酒(工业酒精):CH3OH室内污染:甲醛赤潮:含磷洗衣粉(造成水藻富营养化)
电池:重金属离子污染
高一化学知识点:常见物质的分离、提纯和鉴别集锦合集 4
金属的化学性质
一 金属的通性
1.金属的存在
(1)金属元素的存在
绝大多数金属以化合态的形式存在于自然界中,如Al、Fe等,极少数化学性质不活泼的金属以游离态的形式存在于自然界中,如Au。在地壳中的含量较多的为O、Si、Al、Fe、Ca。
2.金属单质的物理通性
①状态:常温下,大部分为固体,唯一呈液态的是汞。
②色泽:除Cu、Au外,大多数金属为银白色,有金属光泽。
③三性:良好的导电性、导热性、延展性。
3.单质的化学性质
(1)与非金属的反应
常温下,镁在空气中跟氧气反应,生成一层致密的氧化物薄膜,能够阻止内部金属继续被氧化。镁在空气中燃烧,产生耀眼的白光,生成白色固体,反应的化学方程式为:2Mg+O2点燃=====2MgO。镁还可以和氮气点燃,反应方程式为:3Mg+N2点燃=====Mg3N2。
(2)与酸的反应
Fe与稀H2SO4反应的离子方程式:Fe+2H+===Fe2++H2↑。
(3)与盐溶液的反应
Cu与AgNO3溶液反应的离子方程式:Cu+2Ag+===Cu2++2Ag。
归纳总结
金属的通性
(1)金属化学性质特点
(2)金属还原性的强弱取决于其失去电子的难易程度,而不是失去电子个数的多少。
【活学活用】
1.判断下列说法是否正确,正确的划“√”,错误的划“×”
(1)金属具有良好的导热、导电性()
(2)金属单质在氧化还原反应中总是作还原剂()
(3)钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,所以铝比钠活泼()
(4)金属在加热条件下均易与O2反应()
答案 (1)√(2)√(3)×(4)×
解析 (3)错误,金属的活泼性与原子失去电子个数无关,与失电子能力有关,钠比铝易失电子,钠比铝活泼;(4)错误,Au、Pt等金属不与O2反应。
二 钠与氧气的反应
按表中要求完成实验,并将观察到的实验现象及其原因解释填入表中。
[归纳总结]
钠与氧气的反应
(1)钠的性质及其保存
钠是一种硬度小、熔点低的银白色的金属,具有金属光泽。常温下极易被氧化,加热时可燃烧生成淡黄色的Na2O2。
因为钠在空气中极易被氧化,实验室保存钠时应与空气隔绝,通常保存在煤油中。
(2) 钠在常温下与氧气反应的化学方程式是4Na+O2===2Na2O,在加热或点燃时反应的化学方程式是2Na+O2△或点燃=====Na2O2。由此得出的结论是反应条件不同,其产物不同。
(3) 金属钠露置于空气中的主要变化
高一化学知识点:常见物质的分离、提纯和鉴别集锦合集 5
铝的重要化合物必记方程式
一 氧化铝
1.氧化铝是一种白色固体,难溶于水,熔沸点高、硬度大的物质,可用来制造耐火坩埚、耐火管和耐高温的实验仪器等。
2.氧化铝是一种两性氧化物,既能与酸(如盐酸)反应,又能与碱(如NaOH溶液)反应。
(1)氧化铝与盐酸反应的化学方程式是Al2O3+6HCl===2AlCl3+3H2O,
离子方程式是Al2O3+6H+===2Al3++3H2O。
(2) 氧化铝与NaOH溶液反应的化学方程式是Al2O3+2NaOH===2NaAlO2+H2O,
离子方程式是Al2O3+2OH-===2AlO-2+H2O。
二 氢氧化铝
(1)Al(OH)3是一种不溶于水的白色胶状物质。
(2)氢氧化铝既能与酸反应,又能与强碱溶液反应,生成盐和水,所以氢氧化铝具有两性。
氢氧化铝与盐酸反应的离子方程式是Al(OH)3+3H+===Al3++3H2O;
与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-===AlO2-+2H2O。
(3)实验室利用可溶性铝盐(如AlCl3)制备Al(OH)3,应选用氨水,而不用NaOH溶液。
(4)氢氧化铝不稳定,受热易分解,化学方程式是2Al(OH)3△=====Al2O3+3H2O。
(5)Al(OH)3是医用的胃酸中和剂的一种,由于其碱性不强,不至于对胃壁产生强烈刺激或腐蚀作用。
三 Al3+、AlO2-和Al(OH)3间的相互转化
1.Al(OH)3的电离
2.转化关系图示
写出上图标号中有关反应的化学方程式或离子方程式:
(1)① AlCl3+3NH3·H2O====Al(OH)3↓+3NH4Cl;
②AlCl3+3NaAlO2+6H2O====4Al(OH)3↓+3NaCl;
③AlCl3+3NaOH====Al(OH)3↓+3NaCl;
(2)Al(OH)3+3HCl====AlCl3+3H2O;
(3)AlCl3+4NaOH====NaAlO2 + 3NaCl +2H2O;
(4)4HCl+NaAlO2====AlCl3+3NaCl+2H2O;
(5)①AlO2-+CO2(少量)+2H2O===Al(OH)3↓+HCO3-;
②HCl+NaAlO2+H2O====Al(OH)3↓+NaCl;
(6)Al(OH)3+NaOH====NaAlO2+2H2O。
四.用数形结合思想分析Al(OH)3的图像
1.把强碱溶液逐滴加入到铝盐(Al3+)溶液中至过量
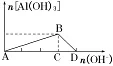
(1)现象:先有白色沉淀产生,然后沉淀逐渐溶解。
(2)有关反应的离子方程式:
A→B:Al3++3OH-===Al(OH)3↓;
B→D:Al(OH)3+OH-===AlO2-+2H2O。
2.把铝盐(Al3+)溶液逐滴加入到强碱溶液中至过量
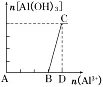
(1)现象:先无明显现象,然后逐渐产生大量的白色沉淀。
(2)有关反应的离子方程式:
A→B:Al3++4OH-===AlO2-+2H2O;
B→C:Al3++3AlO2-+6H2O===4Al(OH)3↓。
3.把强酸溶液逐滴加入到AlO2-溶液中至过量
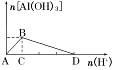
(1)现象:先生成白色沉淀,随后沉淀逐渐溶解。
(2)有关反应的离子方程式:
A→B:AlO2-+H++H2O===Al(OH)3↓;
B→D:Al(OH)3+3H+===Al3++3H2O。
4.向强酸溶液中逐滴加入AlO2-溶液至过量
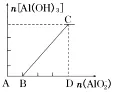
(1)现象:先无明显现象,反应一段时间后逐渐产生白色沉淀。
(2)有关反应的离子方程式:
A→B:4H++AlO2-===Al3++2H2O;
B→C:Al3++3AlO2-+6H2O===4Al(OH)3↓。
5.把Ba(OH)2溶液逐滴加入到明矾溶液中至过量
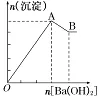
O→A反应:2KAl(SO4)2+3Ba(OH)2===2Al(OH)3↓+3BaSO4↓+K2SO4;
A→B反应:2Al(OH)3+K2SO4+Ba(OH)2===BaSO4↓+2KAlO2+4H2O。
6.向等物质的量的AlCl3、MgCl2混合溶液中逐滴加入NaOH溶液至过量
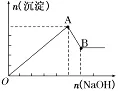
O→A反应:Al3++3OH-===Al(OH)3↓,Mg2++2OH-===Mg(OH)2↓;
A→B反应:Al(OH)3+OH-===AlO2-+2H2O。
五.判断铝元素的存在形式
可溶性铝盐与强碱(如NaOH)溶液反应,铝元素的存在形式
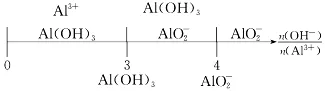
(4)求产物Al(OH)3的量。
①当n(OH-)≤3n(Al3+)时,n[Al(OH)3]=31n(OH-);
②当3n(Al3+)<n(oh-)<4n(al3+)时,n[al(oh)3]=4n(al3+)-n(oh-);< p="">
③当n(OH-)≥4n(Al3+),n[Al(OH)3]=0,无沉淀。
(5)求反应物碱的量。
①若碱不足(Al3+未完全沉淀),n(OH-)=3n[Al(OH)3];
②若碱使生成的Al(OH)3部分溶解,n(OH-)=4n(Al3+)-n[Al(OH)3]。


