金属及其化合物化学知识点精选合集
相关文章
在化学方程式中标出组成元素的化合价,只要有一种元素的化合价发生了变化,即说明该反应是氧化还原反应。今天小编在这给大家整理了高一化学必修一氧化还原反应知识点,接下来随着小编一起来看看吧!
金属及其化合物化学知识点精选合集 1
有机物的概念
1、定义:含有碳元素的化合物为有机物(碳的氧化物、碳酸、碳酸盐、碳的'金属化合物等除外)
2、特性:
①种类多
②大多难溶于水,易溶于有机溶剂
③易分解,易燃烧
④熔点低,难导电、大多是非电解质
⑤反应慢,有副反应(故反应方程式中用“→”代替“=”)
甲烷
烃—碳氢化合物:仅有碳和氢两种元素组成(甲烷是分子组成最简单的烃)
1、物理性质:无色、无味的气体,极难溶于水,密度小于空气,俗名:沼气、坑气。
2、分子结构:CH4:以碳原子为中心,四个氢原子为顶点的正四面体(键角:109度28分)。
3、化学性质:
①氧化反应:(产物气体如何检验?)
甲烷与KMnO4不发生反应,所以不能使紫色KMnO4溶液褪色
②取代反应:(三氯甲烷又叫氯仿,四氯甲烷又叫四氯化碳,二氯甲烷只有一种结构,说明甲烷是正四面体结构)
4、同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质(所有的烷烃都是同系物)
5、同分异构体:化合物具有相同的分子式,但具有不同结构式(结构不同导致性质不同)
烷烃的溶沸点比较:碳原子数不同时,碳原子数越多,溶沸点越高;碳原子数相同时,支链数越多熔沸点越低,同分异构体书写:会写丁烷和戊烷的同分异构体。
乙烯
1、乙烯的制法:
工业制法:石油的裂解气(乙烯的产量是一个国家石油化工发展水平的标志之一)。
2、物理性质:无色、稍有气味的气体,比空气略轻,难溶于水。
3、结构:不饱和烃,分子中含碳碳双键,6个原子共平面,键角为120°。
4、化学性质:
(1)氧化反应:C2H4+3O2=2CO2+2H2O(火焰明亮并伴有黑烟)。
可以使酸性KMnO4溶液褪色,说明乙烯能被KMnO4氧化,化学性质比烷烃活泼。
(2)加成反应:乙烯可以使溴水褪色,利用此反应除乙烯。
乙烯还可以和氢气、氯化氢、水等发生加成反应。
CH2=CH2+H2→CH3CH3CH2=CH2+HCl→CH3CH2Cl(一氯乙烷)
CH2=CH2+H2O→CH3CH2OH(乙醇)
金属及其化合物化学知识点精选合集 2
一.硅元素的性质有哪些?
无机非金属材料中的主角,在地壳中含量26.3%,次于氧。是一种亲氧元素,以熔点很高的氧化物及硅酸盐形式存在于岩石、沙子和土壤中,占地壳质量90%以上。位于第3周期,第ⅣA族碳的下方。
i 对比C
最外层有4个电子,主要形成四价的化合物。
二.二氧化硅(SiO2)的性质有哪些?
(1)存在形式:天然存在的二氧化硅称为硅石,包括结晶形和无定形。石英是常见的结晶形二氧化硅,其中无色透明的就是水晶,具有彩色环带状或层状的是玛瑙。二氧化硅晶体为立体网状结构,基本单元是[SiO4],因此有良好的物理和化学性质被广泛应用。(玛瑙饰物,石英坩埚,光导纤维)
(2)物理性质:熔点高、硬度大、不溶于水、洁净的SiO2无色透光性好。
(3)化学性质:化学稳定性好,除HF外一般不与其他酸反应,可以与强碱(NaOH)反应,属于酸性氧化物,在一定的条件下能与碱性氧化物反应。
①常温与氢氟酸(HF)反应(SiO2很不活泼,HF是唯一能跟其反应的酸)
iO2+4HF == SiF4 ↑+2H2O
②酸性氧化物:不溶于水,也不与水反应。
与强碱反应:SiO2+2NaOH == Na2SiO3+H2O
与碱性氧化物反应:SiO2+CaO ===高温CaSiO3
所以不能用玻璃瓶装HF,装碱性溶液的试剂瓶应用木塞或胶塞。
注:
a、实验室盛装NaOH溶液的试剂瓶为什么用橡胶塞而不用玻璃塞?
aOH溶液能与玻璃中的SiO2反应生成Na2SiO3,Na2SiO3的水溶液俗称“水玻璃”,是一种黏合剂,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞或木塞。
、实验室为什么不用玻璃瓶盛装氢氟酸?
HF能腐蚀玻璃,因此,盛装氢氟酸不能用玻璃试剂瓶而要用塑料瓶。
c、某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物,是否正确?
不正确。因为二氧化硅只跟氢氟酸反应,不跟其它酸反应,而是属于酸性氧化物。
③在高温下与碳酸盐的反应
iO2 + Na2CO3===高温CO2↑ + Na2SiO3
iO2+ CaCO3===高温CO2↑ + CaSiO3
④弱氧化性
iO2+2C ===高温Si + 2CO↑
(4)用途
主要用作装饰、石英坩埚、光导纤维。
三.硅酸(H2SiO3)的性质有哪些?
(1)物理性质:硅酸是一种白色固体,溶解度很小,而且是一种弱酸,酸性比H2CO3还弱。
(2)制备(强酸制弱酸):由于SiO2不溶于水,硅酸应用可溶性硅酸盐和其他酸性比硅酸强的酸反应制得。
a2SiO3+2HCl == H2SiO3↓+2NaClSiO32-+ 2H+== H2SiO3↓
a2SiO3+H2O+CO2==H2SiO3↓+Na2CO3SiO32-+H2O+CO2==H2SiO3↓+CO32-
硅酸凝胶经干燥脱水就形成干胶,称为“硅胶”。
H2SiO3H2O+SiO2
(3)用途
硅胶多孔,吸附水分能力强,常用作实验室和袋装食品,瓶装药品等的干燥剂,也可以用作催化剂的载体。
四.硅酸盐的定义、性质、用途以及表示方法是什么?
(1)定义:硅酸盐是由硅、氧、金属元素组成的化合物的总称。
(2)性质:分布广,结构复杂化学性质稳定。一般不溶于水(Na2SiO3、K2SiO3除外)。
(3)用途:最典型的代表是硅酸钠Na2SiO3 :可溶,其水溶液称作水玻璃和泡花碱,可作肥皂填料、木材防火剂和黏胶剂。硅酸钠水溶液久置在空气中会出现白色浑浊。因为发生下列反应:
a2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
常用硅酸盐产品:玻璃、陶瓷、水泥。
(4)表示方法:
①化学式法:
适用于简单的硅酸盐如:Na2SiO3,K2SiO3、CaSiO3等。
②氧化物法:
活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数。
硅酸钠:Na2SiO3Na2O·SiO2
硅酸钙:CaSiO3CaO·SiO2
高岭石:Al2(Si2O5)(OH)4Al2O3·2SiO2·2H2O
正长石:KAlSi3O8K2O·Al2O3·6SiO2
(5)硅酸盐产品简介:
产品
主要原料
主要设备
反应条件
主要反应或主要成分
水泥
粘土、石灰石、(石膏)适量
水泥回转窑
高温
硅酸三钙:3CaO·SiO2
硅酸二钙:2CaO·SiO2
铝酸三钙:3CaO·Al2O3
玻璃
纯碱、石灰石
石英
玻璃窑
高温
a2CO3+SiO2=Na2SiO3+CO2↑
CaCO3+SiO2=CaSiO3+CO2↑
成分:Na2SiO3、CaSiO3、SiO2
陶瓷
黏土
陶瓷窑
高温
四.硅单质的物理性质有哪些?
(1)物理性质:与碳相似,有晶体和无定形两种。晶体硅结构类似于金刚石,有金属光泽的灰黑色固体,熔点高(1410℃),硬度大,较脆,常温下化学性质不活泼,是良好的半导体。
(2)化学性质:常温下,硅的化学性质不活泼,除氢氟酸、氟气、强碱外不跟其他物质如:氧气、氯气、硫酸等起反应,但在加热情况下,硅也能跟一些非金属反应。
i+2NaOH+H2O == Na2SiO3+2H2↑
(3)制备:SiO2+2C ===高温Si + 2CO↑(得到的只是粗硅,还要进一步提纯)
(4)应用:半导体晶体管及芯片、光电池。
第二节富集在海水中的元素—氯
一.氯元素在元素周期表中的位置?
位于第三周期第ⅦA族,原子结构:容易得到一个电子形成氯离子Cl-,为典型的非金属元素,在自然界中以化合态存在。
二.氯气
1.物理性质物理性质有哪些?
黄绿色气体,有刺激性气味的有毒气体,
可溶于水(1体积水大约溶解2体积的氯气),易液化,
加压和降温条件下可变为液态(液氯)和固态。
2.化学性质有哪些?
(1)与金属反应
①钠与氯气反应
现象:金属钠在氯气中剧烈燃烧,黄色火焰,产生大量的白烟,生成白色固体
2Na+Cl22NaCl
②铁与氯气反应
现象:红热的铁丝在氯气中剧烈燃烧,产生棕黄色的烟;溶于水后溶液呈黄色。
2Fe+3Cl22FeCl3
规律:氯气与变价金属(如Fe、Cu)发生反应,把变价金属氧化成高价的金属氯化物。
③铜与氯气反应
现象:金属铜在氯气中燃烧,产生大量的棕黄色的烟,加水溶解得蓝绿色溶液。
Cu+Cl2CuCl2
(2)与非金属反应
现象:氢气在氯气中安静燃烧,发出苍白色火焰,瓶口呈白雾状。
生成的HCl极易溶于水,与空气中的水蒸气结合形成的盐酸(氢氯酸)小液滴。
H2+Cl22HCl
在点燃(或光照)下氯气均能与氢气反应
实验证明,在一定条件下,Cl2还能与P、S、C等非金属直接化合。
2P+3Cl22PCl3 2P+5Cl22PCl5
燃烧:燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质是剧烈的氧化还原反应,所有发光放热的剧烈化学反应都称为燃烧。
(3)氯气与水的反应
Cl2+H2O == HCl+HClO
在该反应中,Cl2既是氧化剂于是还原剂,转移的电子数为e-。
1体积的水溶解2体积的氯气形成的溶液为氯水,为浅黄绿色。其中次氯酸HClO有强氧化性和漂泊性,起主要的消毒漂白作用。次氯酸有弱酸性(酸性比碳酸还弱),
不稳定,光照或加热分解,因此久置氯水会失效。2HClO ===光照2HCl+O2 ↑
新制氯水和久置氯水的区别?
新制氯水:3分子:Cl2,HClO,H2O4离子:H+,OH-,Cl-,ClO-
久置氯水:分子:H2O离子:H+,Cl-
(4)氯气与碱的反应
漂白液的制取:2NaOH+Cl2=NaClO+NaCl+H2O
漂白液的主要成分是NaClO+NaCl,有效成分是NaClO
漂白粉和漂粉精的制取:2 Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O
漂白粉和漂粉精的主要成分是Ca(ClO)2+CaCl2,有效成分是Ca(ClO)2
漂白粉的漂白原理:
Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
漂白粉失效原理
2HClO 2HCl + O2↑
(5)氯气的实验室制法
MnO2+4HCl (浓) ===△MnCl2+2H2O+Cl2(氯气在饱和食盐水里的溶解度非常小)
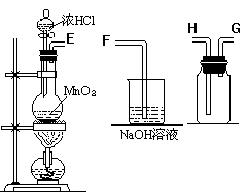
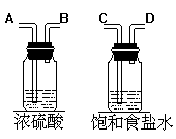
制取氯气吸收氯气收集氯气干燥氯气除去氯化氢
仪器连接顺序:E→C→D→A→B→H→G→F
金属及其化合物化学知识点精选合集 3
1、在任何的化学反应中总伴有能量的变化。
原因:当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。化学键的断裂和形成是化学反应中能量变化的主要原因。一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。E反应物总能量>E生成物总能量,为放热反应。E反应物总能量<e生成物总能量,为吸热反应。< p="">
2、常见的放热反应和吸热反应
常见的放热反应:所有的燃烧与缓慢氧化酸碱中和反应
大多数的化合反应金属与酸的反应
生石灰和水反应(特殊:C+CO22CO是吸热反应)浓硫酸稀释、氢氧化钠固体溶解等
常见的吸热反应:
铵盐和碱的反应如Ba(OH)2·8H2O+NH4Cl=BaCl2+2NH3↑+10H2O
大多数分解反应如KClO3、KMnO4、CaCO3的分解等
以H2、CO、C为还原剂的氧化还原反应如:C(s)+H2O(g)CO(g)+H2(g)。
铵盐溶解等
3.产生原因:化学键断裂——吸热化学键形成——放热
4、放热反应、吸热反应与键能、能量的关系
金属及其化合物化学知识点精选合集 4
1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm
3.标准状况下, Vm = 22.4 L/mol
金属及其化合物化学知识点精选合集 5
1、常温常压下为气态的有机物:1~4个碳原子的烃,一氯甲烷、新戊烷、甲醛。
2、碳原子较少的醛、醇、羧酸(如甘油、乙醇、乙醛、乙酸)易溶于水;液态烃(如苯、汽油)、卤代烃(溴苯)、硝基化合物(硝基苯)、醚、酯(乙酸乙酯)都难溶于水;苯酚在常温微溶与水,但高于65℃任意比互溶。
3、所有烃、酯、一氯烷烃的密度都小于水;一溴烷烃、多卤代烃、硝基化合物的密度都大于水。
4、能使溴水反应褪色的有机物有:烯烃、炔烃、苯酚、醛、含不饱和碳碳键(碳碳双键、碳碳叁键)的有机物。能使溴水萃取褪色的有:苯、苯的同系物(甲苯)、ccl4、氯仿、液态烷烃等。
5、能使酸性高锰酸钾溶液褪色的有机物:烯烃、炔烃、苯的同系物、醇类、醛类、含不饱和碳碳键的有机物、酚类(苯酚)。
有机化学基础知识
6、碳原子个数相同时互为同分异构体的不同类物质:烯烃和环烷烃、炔烃和二烯烃、饱和一元醇和醚、饱和一元醛和酮、饱和一元羧酸和酯、芳香醇和酚、硝基化合物和氨基酸。
7、无同分异构体的有机物是:烷烃:ch4、c2h6、c3h8;烯烃:c2h4;炔烃:c2h2;氯代烃:ch3cl、ch2cl2、chcl3、ccl4、c2h5cl;醇:ch4o;醛:ch2o、c2h4o;酸:ch2o2。
8、属于取代反应范畴的有:卤代、硝化、磺化、酯化、水解、分子间脱水(如:乙醇分子间脱水)等。
9、能与氢气发生加成反应的物质:烯烃、炔烃、苯及其同系物、醛、酮、不饱和羧酸(ch2=chcooh)及其酯(ch3ch=chcooch3)、油酸甘油酯等。
10、能发生水解的物质:金属碳化物(cac2)、卤代烃(ch3ch2br)、醇钠(ch3ch2ona)、酚钠(c6h5ona)、羧酸盐(ch3coona)、酯类(ch3cooch2ch3)、二糖(c12h22o11)(蔗糖、麦芽糖、纤维二糖、乳糖)、多糖(淀粉、纤维素)((c6h10o5)n)、蛋白质(酶)、油脂(硬脂酸甘油酯、油酸甘油酯)等。


