高一化学必修二知识点归纳范文合集
相关文章
高中化学分为必修和选修,化学有许多需要记忆的知识,例如化学方程式、化学实验、化学元素等等,下面给大家分享一些关于化学必修二必考知识点总结,希望对大家有所帮助。
高一化学必修二知识点归纳范文合集 1
反应热与温度和压强等测定条件有关,所以书写时指明反应时的温度和压强,若是标准状态下,即温度为25℃(298.15K)、气压为101kPa时,可以不注明。热化学方程式中化学计量数只表示该物质的物质的量,不表示物质分子个数或原子个数,因此,它可以是整数,也可以是分数。
高一化学必修二知识点归纳范文合集 2
1.不溶是相对的,溶解是绝对的,没有绝对不溶的物质。
2.溶液都是混合物。
3.汽油可以除去油污是因为油污可溶于汽油,洗洁精可以除去油污是因为它可以乳化油污。
4.气体、液体、固体均可以作为溶质,不溶于水的液体也可能可以溶解于其它液体,比如碘可以溶解于酒精。
5.说溶解度的时候要注意三点:温度,单位,饱和。
6.溶质在溶剂中可以以原子、分子、离子的形式存在。
8.同一溶剂中可以溶解多种溶质:比如饱和的食盐水中仍然可以溶解蔗糖。
高一化学必修二知识点归纳范文合集 3
硅酸(H2SiO3)
酸性很弱(弱于碳酸)溶解度很小,由于SiO2不溶于水,硅酸应用可溶性硅酸盐和其他酸性比硅酸强的酸反应制得。
a2SiO3+2HCl==H2SiO3↓+2NaCl
硅胶多孔疏松,可作干燥剂,催化剂的载体。
四、硅酸盐
硅酸盐是由硅、氧、金属元素组成的化合物的总称,分布广,结构复杂化学性质稳定。一般不溶于水。(Na2SiO3、K2SiO3除外)最典型的代表是硅酸钠Na2SiO3:可溶,其水溶液称作水玻璃和泡花碱,可作肥皂填料、木材防火剂和黏胶剂。常用硅酸盐产品:玻璃、陶瓷、水泥
三、硅单质
与碳相似,有晶体和无定形两种。晶体硅结构类似于金刚石,有金属光泽的灰黑色固体,熔点高(1410℃),硬度大,较脆,常温下化学性质不活泼。是良好的半导体,应用:半导体晶体管及芯片、光电池、
四、氯元素:位于第三周期第ⅦA族,原子结构:容易得到一个电子形成
氯离子Cl-,为典型的非金属元素,在自然界中以化合态存在。
五、氯气
物理性质:黄绿色气体,有刺激性气味、可溶于水、加压和降温条件下可变为液态(液氯)和固态。
制法:MnO2+4HCl(浓)MnCl2+2H2O+Cl2
闻法:用手在瓶口轻轻扇动,使少量氯气进入鼻孔。
化学性质:很活泼,有毒,有氧化性,能与大多数金属化合生成金属氯化物(盐)。也能与非金属反应:
2Na+Cl2===(点燃)2NaCl2Fe+3Cl2===(点燃)2FeCl3Cu+Cl2===(点燃)CuCl2Cl2+H2===(点燃)2HCl现象:发出苍白色火焰,生成大量白雾。
燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质是剧烈的氧化还原反应,所有发光放热的剧烈化学反应都称为燃烧。
Cl2的用途:
①自来水杀菌消毒Cl2+H2O==HCl+HClO2HClO===(光照)2HCl+O2↑
1体积的水溶解2体积的氯气形成的溶液为氯水,为浅黄绿色。其中次氯酸HClO有强氧化性和漂泊性,起主要的消毒漂白作用。次氯酸有弱酸性,不稳定,光照或加热分解,因此久置氯水会失效。
②制漂白液、漂白粉和漂粉精
制漂白液Cl2+2NaOH=NaCl+NaClO+H2O,其有效成分NaClO比HClO稳定多,可长期存放制漂白粉(有效氯35%)和漂粉精(充分反应有效氯70%)2Cl2+2Ca
(OH)2=CaCl2+Ca(ClO)2+2H2O
③与有机物反应,是重要的化学工业物质。
④用于提纯Si、Ge、Ti等半导体和钛
⑤有机化工:合成塑料、橡胶、人造纤维、农药、染料和药品
六、氯离子的检验
使用硝酸银溶液,并用稀硝酸排除干扰离子(CO32-、SO32-)
HCl+AgNO3==AgCl↓+HNO3
aCl+AgNO3==AgCl↓+NaNO3
a2CO3+2AgNO3==Ag2CO?3↓+2NaNO3
Ag2CO?3+2HNO3==2AgNO3+CO2↑+H2O
Cl-+Ag+==AgCl↓
七、二氧化硫
制法(形成):硫黄或含硫的燃料燃烧得到(硫俗称硫磺,是黄色粉末)
+O2===(点燃)SO2
物理性质:无色、刺激性气味、容易液化,易溶于水(1:40体积比)
化学性质:有毒,溶于水与水反应生成亚硫酸H2SO3,形成的溶液酸性,有漂白作用,遇热会变回原来颜色。这是因为H2SO3不稳定,会分解回水和SO2
O2+H2OH2SO3因此这个化合和分解的过程可以同时进行,为可逆反应。
可逆反应——在同一条件下,既可以往正反应方向发生,又可以向逆反应方向发生的化学反应称作可逆反应,用可逆箭头符号连接。
八、一氧化氮和二氧化氮
一氧化氮在自然界形成条件为高温或放电:N2+O2========(高温或放电)2NO,生成的一氧化氮很不稳定,在常温下遇氧气即化合生成二氧化氮:2NO+O2==2NO2一氧化氮的介绍:无色气体,是空气中的污染物,少量NO可以治疗心血管疾病。
二氧化氮的介绍:红棕色气体、刺激性气味、有毒、易液化、易溶于水,并与水反应:3NO2+H2O==2HNO3+NO这是工业制硝酸的方法。
九、大气污染
O2、NO2溶于雨水形成酸雨。防治措施:
①从燃料燃烧入手。
②从立法管理入手。
③从能源利用和开发入手。
④从废气回收利用,化害为利入手。
(2SO2+O22SO3SO3+H2O=H2SO4)
高一化学必修二知识点归纳范文合集 4
物质的简单分类及其依据
1.简单分类方法
树状分类法:多种物质按同一依据逐级分类
交叉分类法:同一物质按不同依据分属不同种类。如:
2.物质的简单分类及其依据
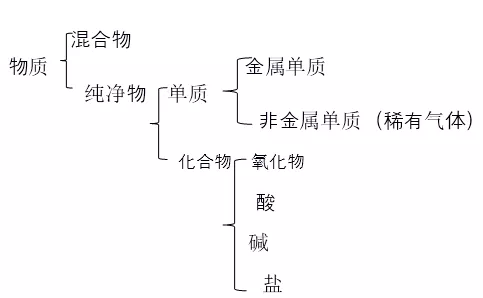
(一)氧化物及其分类
(1). 金属氧化物: Na2O MgO Al2O3 Na2O2 Fe3O4
非金属氧化物: CO CO2 NO NO2 SO2 SO3 H2O H2O2
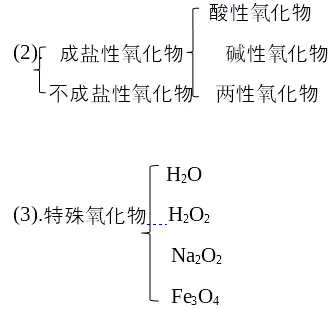
①定义
②举例
③酸性氧化物与非金属氧化物
碱性氧化物与金属氧化物
④酸性氧化物与水反应的关系、酸酐的分析
⑤碱性氧化物与水反应的关系
碱加热分解的情况分析
⑥酸性氧化物与碱性氧化物的反应
(二)酸及其分类
(1)、 无氧酸: H2S HF HCl HBr HI HCN
含氧酸: H2CO3 HNO3 H3PO4 H2SO4 H2SO3 H2SiO3 HClO
(2)、一元酸、 二元酸 、三元酸
(3) 强酸:HCl HBr HI H2SO4 HNO3 HClO4
弱酸:H2CO3 H2SO3 HClO CH3COOH H3PO4 H2S HF HCN
(4)、 可溶性酸
难溶性酸 (H2SiO3、H4SiO4)
(5)、 强氧化性酸:浓H2SO4 HNO3 HClO
非氧化性酸
补充:酸的定义和通性:(由H+表现出来的性质)
(1)使指示剂变色:紫色石蕊变红
(2)与较活泼金属反应置氢
(3)酸碱中和反应
(4)与碱性氧化物反应
(5)与部分盐反应(强酸制弱酸)
(三)碱及其分类
1、 一元碱 NaOH KOH NH3.H2O
二元碱 Ca(OH)2 Ba(OH)2
多元碱 Fe(OH)3
2、 强碱 NaOH KOH Ca(OH)2 Ba(OH)2
弱碱 NH3.H2O及难溶性碱
注: H+ + AlO2- + H2O ? Al(OH)3 ? Al3+ + 3OH-
(一元弱酸) 两性氢氧化物 (三元弱碱)
补充:碱的定义和通性(由OH-体现的性质)
(1)紫色石蕊变蓝、无色酚酞变红
(2)酸碱中和
(3)与酸性氧化物反应
(4)与部分盐反应(强碱制弱碱)
(四)盐的分类 (定义:金属阳离子或氨根离子与酸根离子)
(1)、依据阳离子的种类:钠盐、钾盐、铵盐等
(2)、依据酸根离子:盐酸盐(Cl-) 碳酸盐(CO32-) 硫酸盐(SO42-) 硝酸盐(NO3-)
(3)、依据酸碱中和程度 :
正盐
酸式盐 NaHCO3 NaHSO4 NaH2PO4 Na2HPO4
碱式盐 Cu2(OH)2CO3
(4)、依据酸碱的强弱
强酸强碱盐 Na2SO4
强酸弱碱盐 NH4Cl Al2(SO4)3 FeCl3 酸性
弱酸强碱盐 Na2CO3 CH3COONa 碱性
弱酸弱碱盐 CH3COONH4 中 相对强弱
(5)、依据酸碱种类
复盐: KAl(SO4)2
混盐: CaCl2.Ca(ClO)2
高一化学必修二知识点归纳范文合集 5
1.金刚石没有导电性但极其坚硬,石墨能导电但较软,二者属于不同物质,二者之间的变化是化学变化。
2.常温下碳不活泼,但高温下碳可以与许多物质反应。
3.初中阶段,可以认为碳不以离子的形式存在。
4.C02无毒,可溶但不是易溶于水。
5.活泼金属如钾钙钠镁可在二氧化碳中燃烧,生成相应的金属氧化物和碳单质,属于置换反应,这些金属着火不能用二氧化碳灭火器扑灭。
6.一氧化碳中毒是化学变化。
7.二氧化碳使得紫色石蕊变红是因为生成了碳酸,这是一个可逆过程,干燥的二氧化碳不能使石蕊试纸变红。


